

Ikatan Kimia
Sifat kimia suatu unsur ditentukan oleh konfigurasi elektron kulit terluar (elektron valensi) karena kemampuan suatu atom untuk bergabung dengan atom lain. Apabila terjadi interaksi antara dua atom maka akan terjadi perubahan susunan elektron pada ke dua atom tersebut. Perubahan ini dapat mengakibatkan terjadinya tarikan antara kedua atom sehingga dapat bergabung. Tetapi ada kemungkinan lain, yaitu bahwa tidak terjadi tarikan antara kedua atom, dan keduanya tidak dapat bergabung. Ini artinya bahwa apabila terbentuk suatu melekul dari dua atau beberapa atom, susunan elektron dalam atom yang membentuk molekul itu telah berbeda dengan susunan elektron dalam atom bebas.
Sebelum kalian membaca materi ikatan kimia, coba perhatikan animasi ikatan ion, kovalen dan hidrogen berikut untuk memudahkan kalian memahami materi pada bab ini.


-
Ikatan Kimia
-
Teori Lewis
Unsur-unsur gas mulia merupakan unsur paling stabil. Kestabilan ini disebabkan oleh susunan 8 elektron di kulit terluar, kecuali helium (mempunyai konfigurasi elektron penuh). Hal ini dikenal dengan konfigurasi oktet, kecuali helium dengan konfigurasi duplet.
Unsur-unsur lain dapat mencapai konfigurasi oktet dengan membentuk ikatan agar dapat menyamakan konfigurasi elektronnya dengan konfigurasi elektron gas mulia terdekat. Kecenderungan ini disebut aturan oktet. Konfigurasi oktet (konfigurasi stabil gas mulia) dapat dicapai dengan melepas, menangkap, atau memasangkan elektron. Dalam mempelajari materi ikatan kimia ini, kita juga perlu memahami terlebih dahulu tentang lambang Lewis. Lambang Lewis adalah lambang atom disertai elektron valensinya. Elektron dalam lambang Lewis dapat dinyatakan dalam titik atau silang kecil (James E. Brady, 1990).
-
Penyimpangan Kaidah Oktet
Ditemukan beberapa senyawa kovalen yang tidak sesuai dengan aturan oktet, tetapi dapat terbentuk dan cukup stabil. Hal ini disebut, pengecualian aturan oktet.
-
Pengecualian dan Kegagalan Aturan Oktet
-
Kestabilan Atom
-
Peran Elektron dalam Ikatan Kimia
-
Ikatan Ion (Ikatan Elektrovalen)
Ikatan ion pada umumnya terjadi antara atom atom yang mempunyai energi ionisasi rendah dengan atom-atom yang mempunyai afinitas elektron yang besar. Unsur-unsur logam umumnya mempunyai energi ionisasi yang rendah, sedangkan unsur-unsur nonlogam mempunyai afinitas elektron yang tinggi. Dengan demikian, dapat dikatakan bahwa antara unsur-unsur logam dengan unsur-unsur nonlogam umumnya akan membentuk ikatan ion. Setelah atom logam (golongan Alkali dan alkali Tanah) melepaskan elektron valensinya untuk memperoleh struktur atom gas mulia atau struktur stabil, maka atom ini akan berubah menjadi ion positif. Sebaliknya setelah atom non logam (golongan VI A dan golongan halogen) menerima elektron untuk mencapai struktur gas mulia atau oktet, maka atom ini akan berubah menjadi ion negatif.
Selanjutnya antara ion positif dengan ion negatif terjadi gaya elektrostatik dan terbentuklah ikatan ion.Umumnya ikatan ion merupakan ikatan yang kuat, senyawanya merupakan kristal yang besar dari beberapa ion positif dengan beberapa ion negatif.
-
Ikatan Kovalen
Ikatan kovalen merupakan ikatan yang terjadi karena pemakaian pasangan elektron secara bersama. Pasangan elektron ini dapat berasal dari masing-masing atom yang saling berikatan.
Untuk menggambarkan bagaimana ikatan kovalen terjadi, digunakan rumus titik elektron (struktur Lewis). Rumus ini dapat menggambarkan peranan elektron valensi dalam mengadakan ikatan. Rumus Lewis merupakan tanda atom yang di sekelilingnya terdapat titik, silang atau bulatan kecil yang menggambarkan elektron valensi atom yang bersangkutan.
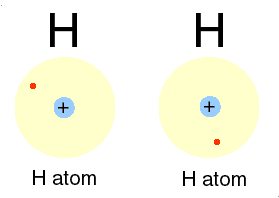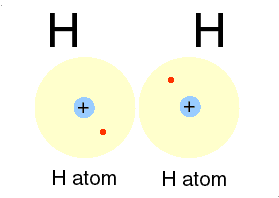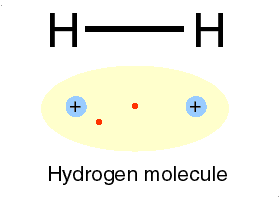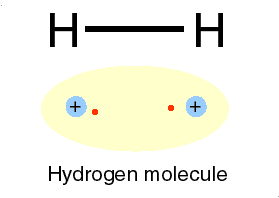
Bila dua atom hidrogen membentuk ikatan, maka masing-masing atom akan menyumbangkan sebuah elektron dan membentuk sepasang elektron yang digunakan bersama. Dengan membentuk pasangan elektron maka masing -masing atom akan mempunyai konfigurasi yang sama dengan atom helium dengan dua elektron pada kulit terluarnya. Sepasang elektron dapat digantikan dengan sebuah garis yang disebut tangan ikatan.
-
Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi terjadi bila pada pembentukan ikatan terdapat pasangan elektron yang hanya berasal dari salah satu atom yang berikatan. Ikatan kovalen koordinasi umumnya terjadi pada mole kul yang juga mempunyai ikatan kovalen.
-
Ikatan Kovalen Polar dan Nonpolar
Pada pembentukan ikatan kovalen tidak terjadi adanya kutub listrik positif dan negatif seperti pada ikatan ion, sebab terjadinya ikatan karena pemakaian pasangan elektron bersama. Meskipun demikian, dalam kenyataannya ada senyawa yang berikatan kovalen, tetapi dapat tertarik oleh medan listrik. Hal ini menunjukkan bahwa ikatan kovalen ada yang menimbulkan kutub-kutub muatan listrik. Terjadinya kutub listrik dalam ikatan kovalen disebut dengan peristiwa polarisasi ikatan (Inggris, polar = kutub). Peristiwa terjadinya polarisasi ikatan ini disebabkan adanya perbedaan kekuatan gaya tarik terhadap pasangan elektron yang digunakan bersama. Besarnya kekuatan gaya tarik elektron dari suatu atom dinyatakan sebagai harga keelektronegatifan. Atom yang mempunyai harga keelektronegatifan lebih besar akan menarik pasangan elektron lebih dekat padanya, sehingga atom tersebut menjadi lebih negatif daripada atom yang kurang kuat gaya tariknya. Makin besar perbedaan harga kelektronegatifan antara kedua atom yang berikatan, makin polar ikatannya. Atom-atom yang tidak mempunyai perbedaan keelektronegatifan, ikatannya merupakan ikatan nonpolar.